推薦新聞
-
供應成都市青花椒魚底料:川味麻香的靈魂密碼多少錢四川味小二食品科技供應
-
供應成都市必嘗之選多少錢四川味小二食品科技供應
-
供應成都市烤魚傳統與創新的味覺盛宴排名四川味小二食品科技供應
-
供應成都市樂山美食之旅:翹腳牛肉價格四川味小二食品科技供應
-
提供成都市讓紅燒雞翅更上一層樓!批發四川味小二食品科技供應
-
提供成都市貴州酸湯:解鎖西南飲食的酸爽靈魂價格四川味小二食品科技供應
-
提供成都市云南有什么底料供應鏈批發四川味小二食品科技供應
-
供應成都市牛油火鍋底料應用教學視頻(一比二兌鍋)直銷四川味小二食品科技供應
-
提供成都市四川家喻戶曉底料生產線廠家四川味小二食品科技供應
-
銷售成都市四川老火鍋底料供應鏈價格四川味小二食品科技供應
上海Sf9宿主細胞蛋白(HCP)殘留檢測
來源:
發布時間:2025-08-24
湖州申科生物參考USP通則<1132.1>闡述的內容,依托公司深耕生物制品質量控制領域十余年經驗,針對LC-MS檢測HCPs方法進行了評價與優化。同時通過對LC-MS檢測HCPs整體流程建立完整的質控,建立起一套抗干擾能力強、穩定性好、準確度高、結果真實可靠的LC-MS檢測HCPs標準方法。檢測技術平臺分成樣品制備、質譜檢測、數據生信分析及質譜結果方法驗證四部分,已使用LC-MS平臺進行了293T、不同工藝E.coli、CHO、Vero、MDCK、Sf9等不同工程細胞HCPs抗體覆蓋率的檢測分析。
湖州申科宿主細胞蛋白(HCP)殘留檢測產品幾乎覆蓋抗體、重組蛋白、疫苗及細胞基因治療領域的頭部企業。上海Sf9宿主細胞蛋白(HCP)殘留檢測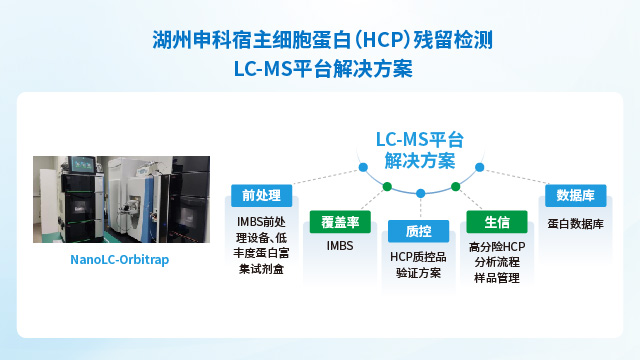
宿主細胞蛋白殘留檢測抗體覆蓋率評估:法規推薦的方法有兩大類:一類是傳統2D-WB法,另一類是基于抗體親和的免疫捕獲類方法。傳統2D-WB法存在需要蛋白變性,樣品需要前處理(破壞蛋白天然表位);轉膜效率低;易產生非特異性等缺陷,難以反映真實的覆蓋率水平。湖州申科自主開發了免疫磁珠捕獲分離技術(immunomagnetic beads separation,IMBS),利用免疫磁珠的半液態性質,可以在懸浮的條件下與HCP樣本充分混勻結合,整個過程蛋白無需變性,結合方式與ELISA檢測條件相似,可以獲得更真實的覆蓋率結果。
上海Sf9宿主細胞蛋白(HCP)殘留檢測生物制品臨床申報需提交 HCP 抗體覆蓋率數據,否則可能面臨監管發補要求。
宿主細胞蛋白通常是與重要細胞功能相關的蛋白,如細胞增殖、基因轉錄、蛋白合成修飾、細胞存活、細胞凋亡等,在工藝過程中分泌或因細胞死亡或裂解而釋放。生產過程中,以下幾個因素會主要影響HCP的組成和豐度:①宿主細胞基因組調控及培養工藝:特定工藝下,潛在的HCP數量可能非常大,且非所有基因都表達,某些基因在不同的時間和條件下表達;如大腸桿菌約4300個基因,不同的工藝產物會經歷獨特的翻譯后修飾,增加了HCP的總數和生化復雜性。有研究表明,如大腸桿菌表達的蛋白,其不同蛋白之間存在數量差異,這些差異可能是對環境條件的適應性反應,但大多數 (85-90%) 有潛在免疫原性的宿主細胞蛋白在不同的發酵過程中都會出現。②產物表達方式:宿主細胞與外源基因、載體和輔助成分組成的體系可以穩定、瞬時和誘導表達;如大腸桿菌常見的表達形式有胞內表達、分泌表達、可溶性表達、不溶性的包涵體形式,以及融合和非融合表達。③純化步驟及產品本身的特性的影響:純化過程中大部分的HCP被去除(>99%),殘留的HCP仍保留在產品中,可能與產品共結合,一起被純化。
影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一是操作規范。一方面,實驗人員的專業技能和經驗對檢測結果的準確性有很大影響。熟練的實驗人員能夠準確地進行樣品處理、試劑配制和儀器操作,減少人為誤差。另一方面,一個合理的HCP檢測方法,在開發及應用時,應當考慮操作的合理變動區間(即耐用性)并設置相質控,從程序上盡量消除人為誤差對結果的影響。此外,嚴格遵循標準操作流程(SOP)是確保檢測結果可靠性的關鍵。操作步驟的不規范可能導致結果的重復性差或誤差增大。目前,湖州申科已正式推出全自動化HCP ELISA檢測系統,可以完成從樣品制備、孵育、洗板至數據采集等一系列操作,結合實驗室信息管理系統(LIMS),可以實現“輸入即輸出”,減少流程誤差。
平臺型試劑盒適用于相近工藝產品線,可適用監測不同產品 HCP 水平。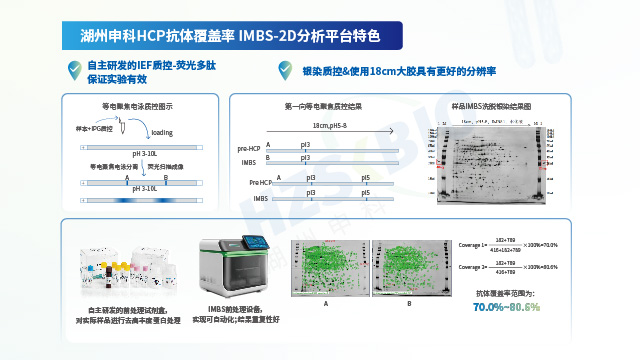
宿主細胞蛋白殘留檢測抗體覆蓋率評估實驗操作復雜,需要在建立實驗方法階段對關鍵步驟進行充分的驗證,以證明實驗方法的穩健性。湖州申科開發的基于磁珠捕獲的IMBS方法(immunomagnetic beads separation),在開發過程中對關鍵步驟進行了充分驗證,相關結果經過專業評審,驗證的內容如下(部分):①方法優化:針對磁珠與抗體的偶聯比例、洗滌液體積、洗滌次數、洗脫次數等關鍵參數進行優化驗證,以保證方法的穩健性;②過程質控:二維電泳存在實驗步驟多,時間跨度長,中間步驟難以控制等缺陷,因此在等電聚焦實驗部分設計了熒光標記多肽,可快速判斷等電聚焦效果。在SDS-PAGE電泳的兩側增加40 ng銀染質控,用于銀染顯色的控制;③方法重復性:針對2D分析以及LC-MS分析進行重復性確認,其中2D分析方法重復性可達到80%以上,LC-MS分析方法可到90%以上;④上樣量優化:針對2D分析以及LC-MS分析進行上樣量確認,消除上樣量差異對檢測結果帶來的影響;⑤假陽性:排除樣品與陰性抗體之間是否存在非特異性結合,確定IMBS實驗所設定的步驟、參數是否有假陽性結果存在。
HCP 定制化開發需構建成熟平臺、技術實力、合規體系、穩定供應、專業團隊及成功案例的全維度支撐體系。成都單抗藥物用宿主細胞蛋白(HCP)殘留檢測湖州申科可根據客戶要求,快速定制符合用戶生產工藝的HCP商業化檢測試劑盒,滿足用戶快速替換的檢測需求。上海Sf9宿主細胞蛋白(HCP)殘留檢測
美國藥典USP通則<1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry(質譜法測定生物藥中殘留宿主細胞蛋白)主要介紹了LC-MS技術在宿主細胞殘留蛋白檢測中的應用,從樣品制備、質譜測試條件的建立、數據的分析、質譜方法驗證等多個方面,詳細闡述了質譜技術在HCPs中應用的優勢與注意事項。作為一種先進的分析技術平臺,質譜技術在HCPs分析中的應用,以及與ELISA方法和其他分析方法結合使用,有助于生產企業在產品的整個生命周期中更好地理解和建立HCPs的檢測方法,保證產品質量的穩定。
上海Sf9宿主細胞蛋白(HCP)殘留檢測
相關新聞
- 重慶宿主細胞殘留DNA檢測銷售廠家 2025-09-16
- 單抗藥物用宿主細胞蛋白(HCP)殘留檢測橋接驗證 2025-09-16
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求 2025-09-16
- 上海生物制品宿主細胞殘留DNA檢測常用知識 2025-09-16
- 定制化宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-09-16
- 遼寧Human宿主細胞殘留DNA檢測生產企業 2025-09-16
- 四川E.coli宿主細胞殘留DNA檢測方案 2025-09-16
- 江蘇CHO宿主細胞殘留DNA檢測方案 2025-09-16
- 河南Vero宿主細胞殘留DNA檢測常見問題 2025-09-16
- 江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測 2025-09-16
推薦新聞
- 天津定制玻璃儀器 2025-09-17
- 包含什么六字真言香囊費用 2025-09-17
- 北京進口葉綠素熒光成像系統 2025-09-17
- 佛山折疊拐杖 2025-09-17
- 河南無噪音護理墊/尿不濕粉碎處理機公司簡介 2025-09-17
- 重慶兒童矯形器裝配 2025-09-17
- 楊浦區本地教育軟件廠家電話 2025-09-17
- 浙江定制脊柱側彎支具型號 2025-09-17
- 山西糞便自動糞菌分離儀運用場景 2025-09-17
- 天津高純透明質酸酶常見問題 2025-09-17