北京E.coli克隆菌宿主細胞蛋白(HCP)殘留檢測
來源:
發布時間:2025-08-21
湖州申科生物CHO-K1 HCP 殘留檢測試劑盒(一步酶聯免疫吸附法)基于固相酶聯免疫吸附分析法,適用于基于CHO-K1細胞生產的生物制品中宿主殘留蛋白的定量檢測。該分析方法通過在預包被抗CHO-K1HCPs綿羊多抗的酶標板中加入校準品或待測樣品、HRP標記的抗CHO-K1HCPs綿羊多抗進行共孵育。洗滌后,加入TMB底物進行顯色反應,再使用終止液終止酶催化反應。利用酶標儀在450nm波長下測讀吸光度,其吸光度與校準品或待測樣品中的HCPs濃度成正相關,通過校準品擬合的劑量-反應曲線即可計算得出待測樣品中HCPs的濃度。本試劑盒對待測樣品無需進行特殊處理,只需通過合適的稀釋比例進行適用性驗證即可直接使用。本試劑盒操作步驟少,快速,檢測專一性強,性能穩定可靠。
篩選HCP試劑盒需考慮線性稀釋(一步法尤重)抗基質干擾穩定檢測值、批間一致性、工藝匹配性等因素。北京E.coli克隆菌宿主細胞蛋白(HCP)殘留檢測
美國藥典USP通則<1132.1> Residual Host Cell Protein Measurement in Biopharmaceuticals by Mass Spectrometry(質譜法測定生物藥中殘留宿主細胞蛋白)主要介紹了LC-MS技術在宿主細胞殘留蛋白檢測中的應用,從樣品制備、質譜測試條件的建立、數據的分析、質譜方法驗證等多個方面,詳細闡述了質譜技術在HCPs中應用的優勢與注意事項。作為一種先進的分析技術平臺,質譜技術在HCPs分析中的應用,以及與ELISA方法和其他分析方法結合使用,有助于生產企業在產品的整個生命周期中更好地理解和建立HCPs的檢測方法,保證產品質量的穩定。
浙江CHO-K1宿主細胞蛋白(HCP)殘留檢測工藝特異型試劑盒針對特定生產流程,準確監控HCP殘留,適配工藝變動。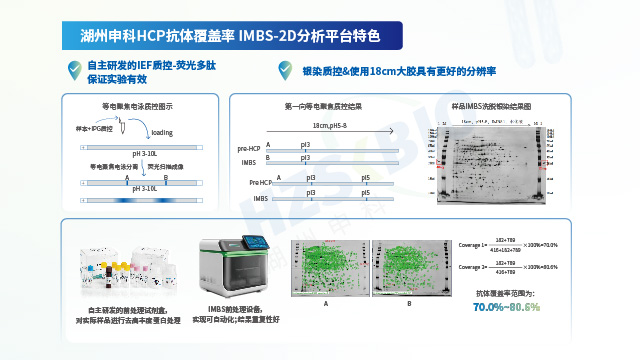
湖州申科在宿主細胞蛋白(HCP)ELISA檢測技術領域擁有深厚的積累,已成功構建高質量、全流程的自有開發平臺,覆蓋HCP檢測試劑盒研發的關鍵環節:①抗原表征與制備:基于合規平臺的HCP Reference/Antigen制備能力,采用2D凝膠電泳等先進技術確保抗原庫的代表性。②動物免疫與抗體制備:依托自有免疫動物平臺,控制免疫原設計與動物免疫過程,產出高特異性、廣覆蓋度的抗體。③體系開發與驗證:憑借成熟的技術經驗開發高靈敏度、高穩定性的檢測體系,并嚴格遵循GMP標準完成方法學驗證。該平臺通過全流程自主可控的技術整合,從源頭保證試劑盒性能的一致性與可靠性,明顯降低不同批次試劑盒的檢測變異性。其研發的HCP ELISA試劑盒已成功服務于國內外200余家生物醫藥企業,為生物制品(如單抗、疫苗)的工藝開發、質量控制及法規申報(如IND/BLA)提供符合監管要求的定制化檢測解決方案。
為了更好地控制工藝和保證產品質量的穩定,各國監管機構均要求提供使用的宿主細胞蛋白殘留檢測ELISA試劑盒的抗體覆蓋率數據。一般需進行覆蓋率分析的場景一般有以下幾種情況:①臨床II期后,若是繼續使用商品化試劑盒,則需要評估試劑盒抗體覆蓋率是否可以繼續用于質量監控;②臨床III期及以后階段,產品研究者開發了平臺化或工藝專屬型的HCP監測方法,該類試劑盒在使用前要評估覆蓋率水平與商業化覆蓋水平的差異;③申報時沒有提交覆蓋率數據,監管機構可能會對企業提出發補的要求;④產品上市后發生了包括生產場地變更,工藝變更,HCP分析方法變更等因素的變更,研究者則需要評估變更前后抗體覆蓋率水平的差異,以及該差異對藥品質量與安全帶來的影響。
宿主細胞蛋白殘留檢測試劑盒的開發不是一個簡單的過程,是一個對平臺、技術均有很高要求的整體流程。
全球快速增長的抗體、蛋白類藥物等生物藥由相應工程細胞生產。生物制品藥物生產過程中的宿主內源性蛋白,被稱為宿主細胞蛋白(Host Cell Proteins, HCPs)會隨著不同工藝流程部分殘留在藥物中。宿主細胞殘留蛋白作為外源蛋白可能會在不同程度上引發機體的免疫應答,導致過敏反應或其它不良反應;另外還有一些殘留HCPs具有蛋白酶或脂酶的活性,可能導致蛋白藥物或輔料的降解,進而增加藥物產品的質量和療效的不穩定性。基于此,對藥物中HCPs的定性與定量檢測就顯得尤為重要。全球各國藥典如美國藥典,歐洲藥典以及中國藥典都對HCPs檢測提出了具體要求和標準。
平臺型試劑盒適用于相近工藝產品線,可適用監測不同產品 HCP 水平。江蘇疫苗產品用宿主細胞蛋白(HCP)殘留檢測方法學驗證不同培養工藝和產物表達影響 HCP 的數量和生化復雜性。北京E.coli克隆菌宿主細胞蛋白(HCP)殘留檢測
按照美國藥典1132章節的要求,HCPs校準品需滿足代表性要求,即能覆蓋實際工藝產品生產中的HCPs。從HCP免疫檢測方法使用目的和預期風險管理要求考慮,滿足工藝開發和驗證,同時為了應對下游工藝中潛在的異常工藝失效,或工藝變更需求,建議采用上游發酵工藝末端,如澄清處理后工藝點的樣本作為HCPs的來源。在實際制備中,可采用空細胞或空載細胞在模擬實際工藝的預定條件進行采集,通過二維電泳或高分辨率質譜等蛋白質組學方法進行模擬工藝和實際工藝下HCPs的代表性表征分析。越靠近下游HCPs蛋白種類越少,也越接近DS中HCPs,但是其可能無法滿足工藝開發和驗證需求,也無法保證工藝的潛在風險,往往不推薦使用,或只作為上游工藝HCPs免疫檢測法的輔助使用。
北京E.coli克隆菌宿主細胞蛋白(HCP)殘留檢測
相關新聞
- 重慶宿主細胞殘留DNA檢測銷售廠家 2025-09-16
- 單抗藥物用宿主細胞蛋白(HCP)殘留檢測橋接驗證 2025-09-16
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求 2025-09-16
- 上海生物制品宿主細胞殘留DNA檢測常用知識 2025-09-16
- 定制化宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-09-16
- 遼寧Human宿主細胞殘留DNA檢測生產企業 2025-09-16
- 四川E.coli宿主細胞殘留DNA檢測方案 2025-09-16
- 江蘇CHO宿主細胞殘留DNA檢測方案 2025-09-16
- 河南Vero宿主細胞殘留DNA檢測常見問題 2025-09-16
- 江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測 2025-09-16
推薦新聞
- 揚州國產智能健康管理系統24小時服務 2025-09-17
- 貴陽一次性醫療針頭一站式制造 2025-09-17
- 天津在哪找面部項目儀器生產企業 2025-09-17
- 北京保持器成型片定制廠家 2025-09-17
- 人抗子宮內膜抗體試劑盒 2025-09-17
- 北京輪式助行器工廠直銷 2025-09-17
- 咽鼓管功能障礙需要中耳負壓治療儀推薦廠家 2025-09-17
- 北京二類械字號葵花商標怎么樣 2025-09-17
- 江西奧托博克1C60小腿假肢 2025-09-17
- 靜安區本地高韌性尼龍 2025-09-17