浙江疫苗產品用宿主細胞蛋白(HCP)殘留檢測方法學驗證
來源:
發布時間:2025-08-21
各國法規要求必須對生物藥品進行分析和純化,以將宿主細胞蛋白HCP降低到可接受的水平;即使終產品中痕量的宿主細胞蛋白HCP到達患者體內,尚不清楚特定的殘留蛋白質雜質是否會影響藥物的穩定性或免疫原性。關于HCP的限量標準,美國藥典推薦值為終產品的HCP水平1-100 ng/mg;中國藥典各論中E.coli菌體HCP應不高于蛋白質總量的0.10% (1000 ng/mg),CHO細胞HCP應不高于蛋白質總量的0.05% (500 ng/mg),假單胞菌HCP應不高于蛋白質總量的0.02% (200 ng/mg)。
不同培養工藝和產物表達影響 HCP 的數量和生化復雜性。浙江疫苗產品用宿主細胞蛋白(HCP)殘留檢測方法學驗證
為什么定制化試劑盒是宿主細胞蛋白殘留檢測的優先選擇?這與檢測準確性和藥物安全性密切相關。HCP ELISA 檢測作為多分析物檢測方法,其結果準確性高度依賴校準品、抗體質量及檢測方法建立。定制化 HCP ELISA 檢測試劑盒的關鍵優勢在于,它基于更具代表性的 HCP 抗原免疫動物,由此產生的 HCP 抗體針對性更強。這種針對性抗體能極大降低 HCP 漏檢風險,尤其對生產工藝中特有的高風險 HCP 因子,展現出更優的檢出效果,為藥物的安全有效和質量可控提供有力保障。
上海通用型宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求部分數據表明,定制化HCP檢測試劑盒的檢測準確度比商業化試劑盒高,更能滿足產品質量控制所需。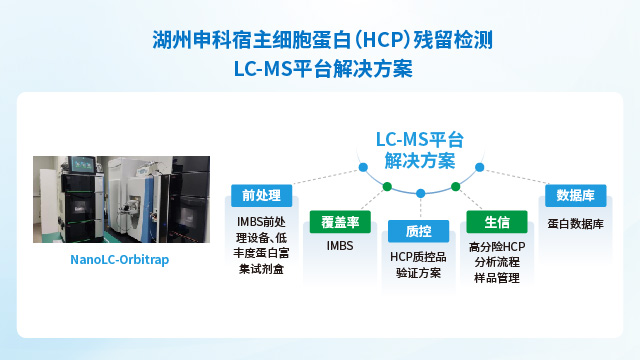
大腸桿菌具有遺傳性狀清晰,易于培養和控制,表達水平高,成本低,周期短等特點,是優先的經濟實惠的蛋白表達系統,K-12系列和B系列菌株是工業規模上常用于生物工程的E.coli細菌株。K-12菌種、所衍生出的DH5α、Top10、JM109等菌株,可用于大量生產質粒DNA并進一步制備細胞基因治療產品和病毒載體類疫苗。源于B系的菌株,如BL21,更適用于高效轉染表達載體和常規蛋白的表達,如:病毒蛋白、重組蛋白疫苗、細胞因子、酶類等產品。湖州申科生物針對這兩種菌株的特點,分別開發了E.coli表達菌HCP殘留檢測試劑盒和E.coli克隆菌堿裂HCP殘留檢測試劑盒。
影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一是方法選擇。酶聯免疫吸附法(ELISA法)和液相色譜-質譜聯用方法(LC-MS法)是目前HCP檢測的兩大常用方法。文獻統計顯示,目前對于總HCP定量,ELISA仍是主流方法;MS法作為對特定蛋白(例如,高風險蛋白)的鑒定和定量,已成為重要的互補手段。此外檢測過程中使用的試劑和耗材的質量直接影響檢測結果的準確性。低質量的試劑可能導致假陽性或假陰性結果。例如,抗體的特異性和親和力不足,可能導致ELISA檢測中的交叉反應;抗原代表性不強或是抗體覆蓋率低,可能會導致漏檢;稀釋液抗干擾能力弱,可能影響檢測準確性。案例研究表明,采用定制化方法替代原有商業化試劑盒后,抗原代表性和抗體覆蓋率明顯提高,HCP檢測值整體升高。
宿主細胞蛋白殘留檢測試劑盒的開發不是一個簡單的過程,是一個對平臺、技術均有很高要求的整體流程。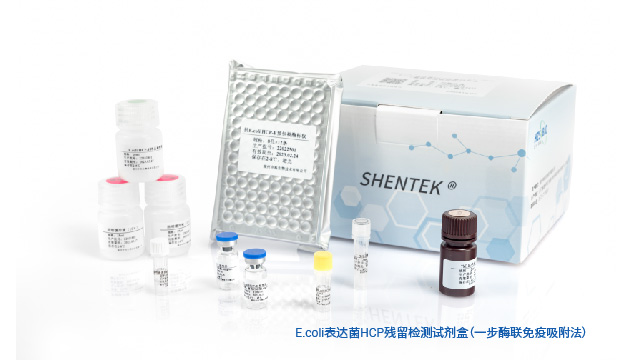
目前通過Vero細胞培養的病毒有狂犬病病毒、脊髓灰質炎病毒等,種類繁多,工藝也各有千秋。湖州申科生物Vero細胞裂解型HCP殘留檢測試劑盒(一步酶聯免疫吸附法)針對工藝過程中Vero細胞裂解后產生的大量不同種類的HCPs,可定量檢測使用Vero細胞系生產并通過細胞裂解工藝收獲的生物制品中宿主細胞蛋白的殘留檢測,抗體與校準品可覆蓋近3000種蛋白。試劑盒操作簡便,提高實驗人員的時間利用率。試劑盒抗體覆蓋率為65.1%-85.1%(IMBS-2D)和76.9%(IMBS-MS,Unique Peptide≥2)。試劑盒嚴格遵循ISO13485質量體系進行生產,并按照法規要求進行了性能驗證,各項性能滿足Vero宿主細胞蛋白檢測需求。
湖州申科可根據客戶要求,快速定制符合用戶生產工藝的HCP商業化檢測試劑盒,滿足用戶快速替換的檢測需求。生物制品宿主細胞蛋白(HCP)殘留檢測方法學驗證湖州申科HCP試劑盒開發經抗原表征、抗體制備到體系驗證,全流程符合法規要求。浙江疫苗產品用宿主細胞蛋白(HCP)殘留檢測方法學驗證
宿主細胞蛋白(HCP)ELISA定制化開發平臺需要具備完善的開發體系,可靠的技術平臺,專業的開發團隊,以實現長期穩定供應符合法規要求的試劑盒。其中校準品作為關鍵原材料,其良好的穩定性和溯源保障對生命周期至關重要。為確保校準品的穩定,一般采用凍干工藝制備校準品,用單因素方差分析方法對校準品進行均一性評估,采用法規規定的蛋白定量方法進行校準品的賦值,并溯源至國家標準品(如有)或BSA國家標準品。其次,由于HCPs是復雜的多分析物,為制備盡可能高覆蓋率的抗體,覆蓋工藝下特有的高風險HCPs,需采用可靠的免疫策略。得到符合性能要求的抗體后,需采用經過驗證的可靠的2D或LC-MS方法進行抗體覆蓋率的表征,以確保抗體可以充分覆蓋各實際工藝下產生的HCPs。得到了具有代表性的抗原和性能優良的抗體后,便是ELISA檢測體系的開發,主要包括原輔料的篩選和制備研究、各組分工藝及反應體系研究、穩定性研究等。在檢測體系開發完成后,需要根據ICH及藥典要求進行分析方法驗證的評估,以確保整個檢測體系的線性、范圍、檢測限、定量限、準確度、精密度、專屬性以及耐用性等可以滿足法規要求。
浙江疫苗產品用宿主細胞蛋白(HCP)殘留檢測方法學驗證
相關新聞
- 重慶宿主細胞殘留DNA檢測銷售廠家 2025-09-16
- 單抗藥物用宿主細胞蛋白(HCP)殘留檢測橋接驗證 2025-09-16
- 浙江定制化宿主細胞蛋白(HCP)殘留檢測試劑盒開發要求 2025-09-16
- 上海生物制品宿主細胞殘留DNA檢測常用知識 2025-09-16
- 定制化宿主細胞蛋白(HCP)殘留檢測抗體制備 2025-09-16
- 遼寧Human宿主細胞殘留DNA檢測生產企業 2025-09-16
- 四川E.coli宿主細胞殘留DNA檢測方案 2025-09-16
- 江蘇CHO宿主細胞殘留DNA檢測方案 2025-09-16
- 河南Vero宿主細胞殘留DNA檢測常見問題 2025-09-16
- 江蘇單抗藥物用宿主細胞蛋白(HCP)殘留檢測 2025-09-16
推薦新聞
- 揚州國產智能健康管理系統24小時服務 2025-09-17
- 貴陽一次性醫療針頭一站式制造 2025-09-17
- 天津在哪找面部項目儀器生產企業 2025-09-17
- 北京保持器成型片定制廠家 2025-09-17
- 人抗子宮內膜抗體試劑盒 2025-09-17
- 北京輪式助行器工廠直銷 2025-09-17
- 咽鼓管功能障礙需要中耳負壓治療儀推薦廠家 2025-09-17
- 北京二類械字號葵花商標怎么樣 2025-09-17
- 江西奧托博克1C60小腿假肢 2025-09-17
- 靜安區本地高韌性尼龍 2025-09-17